Medicazioni e Disinfettanti
MEDICAZIONE TRISTRATIFICATA CON BORDO ADESIVO IN SCHIUMA DIPOLIURETANO E STRATO DI SILICONE A CONTATTO DELLA LESIONE CONFORMATA PER TALLONE ASKINA DRESSIL HEEL 22X21,6 CM 5 PEZZI
- Produttore: B.BRAUN MILANO SPA
- Codice prodotto: 970515351
- Punti fedeltà: 88
- Disponibilità: Articolo esaurito
€ 88,57
- Prezzo in punti fedeltà: 4429
Askina
DresSil Heel
Descrizione Prodotto: Medicazione tristratificata, con bordo adesivo, in schiuma di poliuretano e strato di silicone a contatto del letto della lesione, conformata per il tallone.Codice Prodotto: 5592205F
Divisione: OPM
Prodotto da: B. Braun Hospicare Limited - Co-Sligo Irlanda
Officina di produzione: B. Braun Hospicare Limited - Co-Sligo Irlanda Rappresentato in Italia da: B. Braun Milano S.p.A. Via Vincenzo da Seregno 14 20161 Milano
Certificazione: CE - D.O.C. - ISO
Ente certificatore: 0050
Classe di rischio: Classe II b
Codice CND: M04040702 Medicazione in silicone associato ad altre sostanze.
INDICAZIONI, CONTROINDICAZIONI, AVVERTENZE
Descrizione:
Askina DresSil Heel è una medicazione sterile sagomata per il tallone, costituita da:
• uno strato di silicone munito di fori a contatto con la lesione;
• una schiuma di poliuretano con elevate caratteristiche assorbenti;
• un film esterno impermeabile all'acqua, ma permeabile al vapore.
In presenza di essudato, Askina DresSil Heel aiuta a mantenere il corretto ambiente umido, favorendo le naturali condizioni per la cicatrizzazione.
Dimensioni
22 cm x 21,6 cm pari a 433 cm2 (superficie attiva: 18,9 cm x 18,5 cm pari a 225 cm2).
Indicazioni
Askina DresSil Heel è indicata per il trattamento di lesioni moderatamente essudanti, di spessore parziale o totale.
Controindicazioni
Askina DresSil Heel non dovrebbe essere utilizzata in caso di:
• ulcere da infezioni quali tubercolosi, sifilide;
• infezioni fungine profonde;
• ustioni di terzo grado;
• in caso comparsa di segni di di infezioni o se la lesione peggiora, informare il medico curante.
Riprendere l'utilizzo non appena le normali condizioni sono ripristinate.
Non utilizzare insieme ad agenti ossidanti come ipoclorito di sodio o soluzioni di perossido di idrogeno.
Istruzioni per l'uso
1) Detergere la lesione con una soluzione adatta (ad esempio, Prontosan) seguendo le normali procedure.
2) Asciugare la cute perilesionale.
3) Posizionare la medicazione assicurandosi che rimangano da 2 a 3 cm di medicazione oltre i margini della lesione.
4) Rimuovere uno dei fogli di protezione e applicare il lato adesivo sulla lesione.
5) Fare aderire la medicazione alla lesione rimuovendo l'altro foglio di protezione come da schema.
Rimozione/Sostituzione della medicazione
L'intervallo di sostituzione della medicazione dipende dallo stato della lesione e dalla quantità di essudato. Askina DresSil Heel deve essere sostituita quando è satura di essudato: in media ogni 2 o 3 giorni, oppure ogni 24 ore se la quantità di essudato è rilevante. Sostituire immediatamente in caso di fuoruscite di essudato. Se necessario, utilizzare una soluzione detergente per agevolare la rimozione.
Note speciali
Nelle prime fasi del trattamento, la lesione potrebbe apparire più estesa. Si tratta di un fenomeno normale, dovuto alla rimozione del tessuto necrotico alle estremità della lesione. Questo agevola il processo di cicatrizzazione. In alcuni casi le condizioni generali precludono la cicatrizzazione e il solo trattamento con Askina DresSil Heel potrebbe portare a risultati modesti o irrilevanti, quindi risulta necessario un trattamento adeguato delle condizioni generali del paziente. Se dopo un trattamento di 4-6 settimane con Askina DresSil Heel non si ottengono risultati significativi, in conformità alla prassi di gestione delle lesioni comunemente accettata, occorre rivedere la diagnosi originale e il regime terapeutico generale.
Avvertenze
Il riutilizzo di dispositivi monouso crea un potenziale rischio sia per il paziente che per l'operatore. Può provocare contaminazione e/o riduzione della funzionalità del dispositivo, che possono dar luogo a lesioni, malattie o anche al decesso del paziente.
Sterile se la confezione è integra e chiusa.
INFORMAZIONI TECNICHE
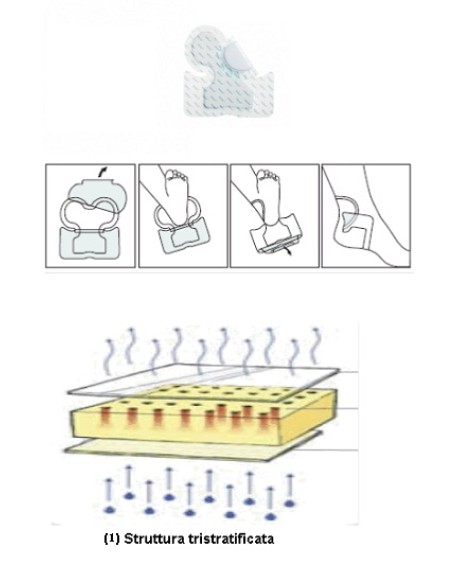
Struttura tristratificata(1)
• Strato a contatto con la lesione: pellicola in Silicone di Grado Medicale, munita di una particolare architettura di fori che consentono il passaggio dell'essudato al successivo strato in schiuma di poliuretano. La struttura dei fori è caratterizzata da una matrice che si ripete in tutta l'estensione dello strato di silicone ed è costituita da un foro centrale del diametro di 5 mm circondato da 6 fori del diametro di 3 mm. Questa composizione permette di garantire le caratteristiche di atraumaticità tipiche dell'interfaccia di silicone, consentendo nel contempo, il corretto assorbimento dell'essudato. La capacità adesiva della medicazione è data sia dal silicone, che ha insita nelle proprie caratteristiche questa proprietà, sia dal bordo adesivo, che mantiene stabile la medicazione ed impedisce l'infiltrazione di liquidi e quindi la possibile contaminazione. Ciò consente, alla medicazione, di mantenere il corretto posizionamento sulla lesione. La presenza del film di silicone a contatto con il letto della lesione, consente una considerevole riduzione del dolore al cambio della medicazione, rispetto ad una normale schiuma di poliuretano. Il film di silicone, infatti protegge il tessuto neoformato e la cute perilesionale, riducendo lo stripping cellulare durante il cambio della medicazione. L'immagine al microscopio elettronico, rappresenta la superficie di silicone in corrispondenza di un foro dal quale si intravede la struttura alveolare della schiuma di poliuretano.
• Strato intermedio: Struttura idrocellulare assorbente idrofila costituita da schiuma di poliuretano. Permette un elevato assorbimento "verticale" dell'essudato, senza rilascio sotto pressione. Consente inoltre un'ottima gestione dell'ambiente umido ed elimina i rischi di macerazione dei bordi della lesione.
• Strato esterno: Film di poliuretano impermeabile ai liquidi ed ai batteri e gas permeabile. Ciò consente la traspirazione dei tessuti, mantenendo il giusto ambiente umido, lasciando evaporare i liquidi in eccesso.
• Bordo adesivo: Composto da Film di poliuretano impermeabile ai liquidi ed ai batteri e gas permeabile, associato a una pellicola in Silicone di Grado Medicale, munita di una particolare architettura di fori che garantisce le caratteristiche di atraumaticità tipiche dell'interfaccia di silicone. La presenza del film di silicone a contatto con la cute perilesionale, consente una considerevole riduzione del dolore al cambio della medicazione, rispetto ai normali adesivi acrilici.
| Monouso | SI | |
| Sterile alla vendita | Sterile | |
| Metodo di sterilizzazione | Sterilizzazione a ossido di etilene | |
| Risterilizzabile | Non risterilizzabile | |
| Mesi validità | A confezionamento integro ed in corretto stato di conservazione: 36 mesi | |
| Presenza di Lattice | No | |
| Confezionamento | Medicazione in materiale sintetico (silicone) e schiuma di poliuretano, confezionata singolarmente, contenuta in scatole da 5 medicazioni | |
| Temperatura di conservazione | Conservare a temperatura ambiente lontano da fonti di calore e umidità | |
| Biocompatibilità | Si | |
| I dispositivi sono sottoposti e soggetti a test di biocompatibilità secondo gli standard internazionali: ISO 10993 -1 Valutazioni Biologiche dei dispositivi medici Part. 1: valutazione e test | ||
| Ftalati | No | |
| Anno inizio commercializzazione | 2016 |
| Carateristiche tecniche: | Valori | Test Method |
| Spessore totale: | circa 4,11 mm | 11:38 |
| Spessore pellicola esterna in poliuretano semipermeabile: | 30 micron | EN 13726-1: 2002 |
| Spessore schiuma di poliuretano di Grado Medicale: | 4,0 mm | EN 13726-1: 2002 |
| Spessore strato di silicone di Grado Medicale: | 0,11 mm | EN 13726-1: 2002 |
| Peso strato di silicone di Grado Medicale: | 250 g/m2 | EN 13726-1: 2002 |
| Larghezza bordo adesivo: | 15 mm | |
| Spessore bordo adesivo: | 0,45 mm | |
| Peso: | 659 g/m2 | |
| pH: | 9,8 | |
| Assorbimento capillaritico: | 38 secondi | TMRD-078 |
| Capacità adesiva (superficie in acciaio): | N/25 mm | 11:35 |
| MTVR (permeabilità): | 1,525 g/m2/24 h 0,15 g/cm2/24 h | EN 13726-1: 2002 EN 13726-1: 2002 |
| Water Vapor Trasmission Rate: | 10,9 g/10 cm2/24 h | EN 13726 -1: 2002 |
| Assorbimento dopo 24 h: | 4900 g/m2/24 h 0,4900 g/cm2/24 h 0,49 g/cm2/24 h | EN 13726-1: 2002 EN 13726-1: 2002 EN 13726-1: 2002 |
| Assorbimento dopo 72 h: | 4900 g/m2/72 h 0,4900 g/cm2/72 h 0,49 g/cm2/72 h | EN 13726-1: 2002 EN 13726-1: 2002 EN 13726-1: 2002 |
| Assorbimento sotto compressione (40 mm-Hg) dopo 24 h: | 2658 g/m2/24 h 0,2658 g/cm2 4,03 g/g | EN 13726-1: 2002 |
| Fluid Handling Capacity dopo 24 h: | 15800 g/m2/24 h 1,5800 g/cm2/24 h | EN 13726-1: 2002 |
| Fluid Handling Capacity dopo 72 h: | 21118 g/m2/24 h 2,1118 g/cm2/24 h | EN 13726-1: 2002 |
| Adesività N/25 mm: | 0,258 N/25 mm | 11:39 |
| Tempo di permanenza in situ: | 7 giorni |
Cod.5592205F
